大石クリニック内で行われる研究の倫理審査について(院内向け)
審議課題名及び議事要旨
倫理審査の流れ
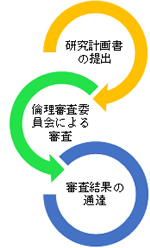 研究代表者は院内所定の書式に従って研究計画書等必要書類を作成し、一式を院長へ提出してください。提出された研究計画書に基づき、倫理審査委員会が研究内容に問題がないか審査を行います。
研究代表者は院内所定の書式に従って研究計画書等必要書類を作成し、一式を院長へ提出してください。提出された研究計画書に基づき、倫理審査委員会が研究内容に問題がないか審査を行います。
審査結果は倫理委員会もしくは院長より研究代表者へ書面にて通達されます。研究代表者は、本通達を以て研究開始の承認とし、研究を開始することができます。
審査の対象となる研究と必要書類
大石クリニック内の患者・職員・その他関係者を対象として行われるすべての研究(学会発表)について、原則として審査が必要となります。申請に際しては、所定の書式にしたがい、以下の書類を準備して提出してください。
- 1.研究計画書
- 2.倫理審査申請書
- 3.倫理説明文書
- 4.同意書
上記書類四点を院長あてに提出後、倫理審査委員会の定例会に拠ってこれを審査し、書面にて審査結果を報告します。承認までには申請後数週間かかる可能性がありますので、期限に余裕をもって申請を行ってください。
書類作成に当たって
【作成に関する基本的用語】
作成される書類の内容は、実施される研究の侵襲や介入の有無によって変化します。
侵襲・・・研究目的で行われる、穿刺、切開、薬物投与、放射線照射、心的外傷に触れる質問等によって、研究対象者の死体または精神に傷害又は負担が生じることを言う。侵襲の内、研究対象者の身体及び精神に生じる傷害および負担が小さい物を「軽微な傷害」という。
例)アル症者への治療効果の測定を目的とした採血、過去の人生経験について触れる質問紙の利用、研究を目的とした認知行動療法などの治療プログラムの実施など・・・
介入・・・研究目的で、人の健康に関する様々な事象に影響を与える要因(健康の保持増進につながる行動及び医療における傷病の予防、診断又は治療のための投薬、検査等を含む)の有無または程度を制御する行為(通常の診療を超える医療行為であって、研究目的で実施するものを含む)
例)治療を目的とした投薬の変更、ランダム化比較試験
試料・情報・・・血液、体液、組織、細胞、排泄物およびこれらから抽出したDNA等、人の体の一部であって研究に用いられるものを試料と呼ぶ。情報は研究対象者の診断および治療を通じて得られた傷病名、投薬内容、検査または測定の結果等、人の健康に関する情報その他の情報であって研究に用いられるもの(死者に係るものを含む)を指す。研究を目的として新たにこれらを取得する場合は原則として侵襲に該当するが、研究以前に取得されたか、研究を主たる目的とせずに取得された試料、情報を用いる場合は侵襲には含まれない。
例)わくわくの通院継続率などのデータは、既存情報に当たるため、侵襲には含まれない。
【侵襲や介入の有無に伴う作成書類の違い】
侵襲や介入の有無によって研究計画書の記載内容やインフォームドコンセントの取得方法が変わります。詳細はフォームにも記載がありますが、記載しなければいけない内容は以下の通りです。
-
研究の種類
全ての研究 -
研究計画書に記載すべき内容
1.研究の名称
2.実施体制(研究機関名称、研究者等氏名)
3.目的及び意義
4.方法及び期間
5.対象者の選定方針
6.科学的合理性の根拠
7.インフォームド・コンセントを受ける場合の手続き
8.個人情報等の取扱い
9.研究対象者に生じる負担並びに予想されるリスク及び利益、これらの総合的評価並びに当該負担及びリスクを最小化する対策
10.試料・情報の補完及び廃棄の方法
11.研究機関の長への報告内容及び方法
12.研究の資金源等、研究機関の研究に係る利益相反及び個人の収益等、研究者等の研究に係る利益相反に関する状況
13.研究に関する情報公開の方法
14.研究対象者等及びその関係者からの相談等への対応
15.代諾者等からインフォームド・コンセントを受ける場合の手続き
16.インフォームド・アセントを得る場合の手続き
17.対象者に緊急かつ明白な生命の危機を生じる可能性のある研究をする場合に、これらの研究を行うにあたっての要件(別途確認ください)を満たしていることについて判断する方法
18.研究対象者等に経済的負担または謝礼がある場合には、その旨及びその内容
19.研究の実施に伴い、研究対象者の健康、子孫に受け継がれ得る遺伝的特徴に関する重要な知見が得られる可能性がある場合には、研究対象者に係る研究結果(偶発的所見を含む)の取り扱い
20.研究に関する業務の一部を委託する場合にいは、当該業務内容及び委託先の監督方法
21.研究対象者から取得された試料・情報について研究対象者等から同意を受ける時点では特定されない将来の研究のために用いられる可能性または他の研究機関に提供する可能性がある場合には、その旨と同意を受ける時点において想定される内容
22.モニタリングや監査を実施する場合には、その実施体制及び実施手順
-
研究の種類
侵襲を行う研究 -
研究計画書に記載すべき内容
1.当該研究によって生じた健康被害に対する補償の有無及びその内容
2.通常の診療を超える医療行為を伴う研究の場合は、研究対象者への研究実施後における医療の提供に関する対応
-
研究の種類
介入を行う研究 -
研究計画書に記載すべき内容
1.通常の診療を超える医療行為を伴う研究の場合は、研究対象者への研究実施後における医療の提供に関する対応
【インフォームド・コンセントの受け方】
以下の基準に従ってください。
● 新たに試料・情報を取得する研究
- 侵襲を行う研究
- → 規定の事項を記載した文章によりインフォームド・コンセントを受ける必要がある
- 侵襲はないが、介入を行う研究
- → 文章または口頭でインフォームド・コンセントを受け、口頭の場合は同意を受けた旨に関する記録を作成する
- 侵襲も介入も行わないが、人体から取得された試料を用いる研究
- → 文章または口頭でインフォームド・コンセントを受け、口頭の場合は同意を受けた旨に関する記録を作成する
- 侵襲も介入も行わず、人体から取得された試料も用いない研究
- → 必ずしもインフォームド・コンセントを受ける必要はないが、受けない場合には研究に用いられる情報の利用目的を含む当該研究についての情報を研究対象者等に通知または公開し、研究が継続または実施されることについて、研究対象者等が拒否できる機会を保障しなければならない
● 院内に保有してある既存試料・情報を用いて研究を実施しようとする場合のインフォームド・コンセント
- 人体から取得された試料を用いる研究
- 文書または口頭によりインフォームド・コンセントを受け、口頭の場合にはその旨記録する。ただし、これらの手続きを行うことが困難な場合で、以下の①~③のいづれかに該当する場合には、当該手続きを行うことなく利用することができる
① 試料が匿名化(連結不可能匿名化または連結可能匿名化であって当該研究機関が対応表を保有しない)されていること
② 試料の取得時に当該研究における利用が明示されていない別の研究についての同意のみが与えられており、A.利用目的を含む情報が対象者ヘ通知または公開されているB.同意が当該研究の目的と相当の関連があると合理的に認められる、の2点を満たしていること
③ 当該研究の実施について人体から取得された試料の利用目的を含む情報を研究対象者等に通知または公開しており、かつ研究対象者が研究の実施に当たって拒否できる機会が保障されており、かつ公衆衛生の向上のために特に必要がある場合であって研究対象者等の同意を受けることが困難であること、の3点をすべて満たしている
- 人体から取得された試料を用いない研究
- 必ずしもインフォームド・コンセントを受けることを要しないが、情報が匿名化されている場合を除き、利用目的を含む情報が対象者ヘ通知または公開され、研究対象者が研究の実施に当たって拒否できる機会が保障されていること
【インフォームド・コンセントを受ける際の説明事項】
- 研究の名称及び当該研究の実施について研究機関の長の許可を受けている旨
- 研究機関の名称及び研究責任者の氏名
- 研究の目的及び意義
- 研究の方法(対象者から取得された試料・情報の利用目的を含む)及び期間
- 研究対象者として選定された理由
- 研究対象者に生じる負担並びに予測されるリスク及び利益
- 研究が実施または制限されることに同意した場合であっても随時これを撤回できる旨
- 研究が実施または継続されることに同意しない事または同意を撤回することによって研究対象者等が不利益な取り扱いを受けない旨
- 研究に関する情報公開の方法
- 研究対象者等の求めに応じて、他の研究対象者等の個人情報等の保護及び当該研究の独創性の確保に支障がない範囲内で研究計画書及び研究の方法に関する資料を入手または閲覧できる旨並びにその入手または閲覧の方法
- 個人情報等の取扱い(匿名化する場合にはその方法を含む)
- 試料・情報の保管及び廃棄の方法
- 研究の資金源等、研究機関の研究に係る利益相反及び個人の収益等、研究者等の研究に係る利益相反に関する状況
- 研究対象者等及びその関係者からの相談等への対応
- 研究対象者等に経済的負担または謝礼がある場合には、その旨及びその内容
- 通常の診療を超える医療行為を行う研究の場合には、他の治療方法等に関する事項
- 通常の診療を超える医療行為を伴う研究の場合には、研究対象者への研究実施後における医療の提供に関する対応
- 研究の実施に伴い、研究対象者の健康、子孫に受け継がれ得る遺伝的対応等に関する重要な知見が得られる可能性がある場合には、研究対象者に係る研究結果(偶発的所見を含む)の取り扱い
- 侵襲を伴う研究の場合には、当該研究によって生じた健康被害に対する補償の有無及びその内容
- 研究対象者から取得された試料・情報について、研究対象者等から同意を受ける時点では特定されない将来の研究のために用いられる可能性または他の研究機関に提供する可能性がある場合には、その旨と同意を受ける時点において想定される内容
- 侵襲(軽微な侵襲を除く)を伴う研究であって介入を行うものの場合には、研究対象者の秘密が保全されることを前提とひて、モニタリングに従事する者及び監査に従事する者並びに倫理審査委員会が、必要な範囲内において当該研究対象者に関する試料・情報を閲覧する旨
その他注意事項
※原則として研究内容に変更があった場合には都度倫理審査委員会へ再度審査を受ける必要があります(軽微な変更の場合は迅速審査と言う別の手続きになることもあります)
※研究内容の変更に伴いインフォームド・コンセントの内容に変更がある場合、変更内容に沿って改めてインフォームド・コンセントを受けなおす必要があります
※不明点や詳細は、平成26年12月22日文部科学省・厚生労働省発行の「人を対象とする医学系研究に関する倫理指針」を参照してください
